Химия 8 класс конспекты

Химические элементы и образуемые ими простые вещества можно разделить на 2 большие группы: металлы железо, алюминий, медь, золото, серебро — они пластичны, имеют металлический блеск и хорошо проводят электрический ток, и неметаллы сера, фосфор, водород, кислород, азот. Конспект по химии по теме "Естественные семейства химических элементов" 8 класс. HBO 2.
Атом — мельчайшая химически неделимая частица вещества. Молекула — мельчайшая частица вещества, состав и химические свойства которой, такие же, как у вещества. Химический элемент - определенный вид атомов. Х имическая формула. Количественный состав количество атомов. Качественный состав химические элементы.
Обозначается индексами. Обозначается символами знаками химических элементов. Алгоритм расчета Mr. Определить Ar элементов по таблице Менделеева, округлить.
Умножить Ar на индексы. Полученные значения сложить. Mr вещества. Металлов М Неметаллов неМ. Номеру группы Высшая Низшая. Алгоритм составления. Над символами указать валентности. Найти наименьшее общее кратное. Наименьшее общее кратное разделить на показатели валентностей получим индексы. Полученные индексы записать около символов индекс 1 не пишем. Алгоритм определения. Найти элемент с постоянной валентностью, указать ее. Умножить индекс на валентность.
Полученное значение разделить на индекс другого элемента. Указать валентность второго элемента. П ример: IV : II. Составление формул веществ. Химический знак металла всегда ставят на первое место. На второе место ставят химический знак неметалла, проявляющего низшую валентность. В соединении с металлами неметалл проявляет низшую валентность. В соединении, состоящем из атомов двух неметаллов, элемент, располагающийся в таблице Менделеева правее или выше ближе к фтору , проявляет низшую валентность, а если расположен левее или ниже — высшую.
Алгоритм вывода химической формулы вещества по массовым долям химических элементов. Дано: Решение. А х B y C z 1 составляем соотношение массовых долей элементов в веществе. Химические реакции.
Реакцией разложения называется такая химическая реакция, в которой из одного сложного вещества получается два или несколько простых или сложных веществ. Реакцией соединения называется такая реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно более сложное вещество. Реакцией замещения называется реакция, протекающая между простым и сложным веществами, при которой атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Алгоритм расстановки коэффициентов. Подсчитать количество атомов каждого элемента в правой и левой части. Определить, у какого элемента количество атомов меняется, найти наименьшее общее кратное.
Разделить наименьшее общее кратное на индексы — получить коэффициенты. Поставить коэффициенты перед формулами. Пересчитать количество атомов, при необходимости действия повторить. Начинать уравнивать с атомов, находящихся в составе одного вещества. Моль — это количество вещества, содержащее столько же частиц атомов, молекул , сколько содержится атомов углерода в 0, кг 12г углерода. Молярная масса вещества — это масса одного моля вещества. Вычисление массы и количества вещества. Алгоритм решения задач по уравнениям химических реакций.
Если вещества даны с примесями, то сначала вычисляют массу чистого вещества. Составляют уравнение химической реакции. В уравнении одной чертой подчеркивают химические формулы веществ, массы которых указаны в условии задачи, а двумя чертами — формулы тех веществ, массы которых требуется вычислить.
По уравнению реакции определяют количества моль тех веществ, формулы которых подчеркнуты. Найденные значения пишут под соответствующими химическими формулами и производят вычисления, используя пропорцию.
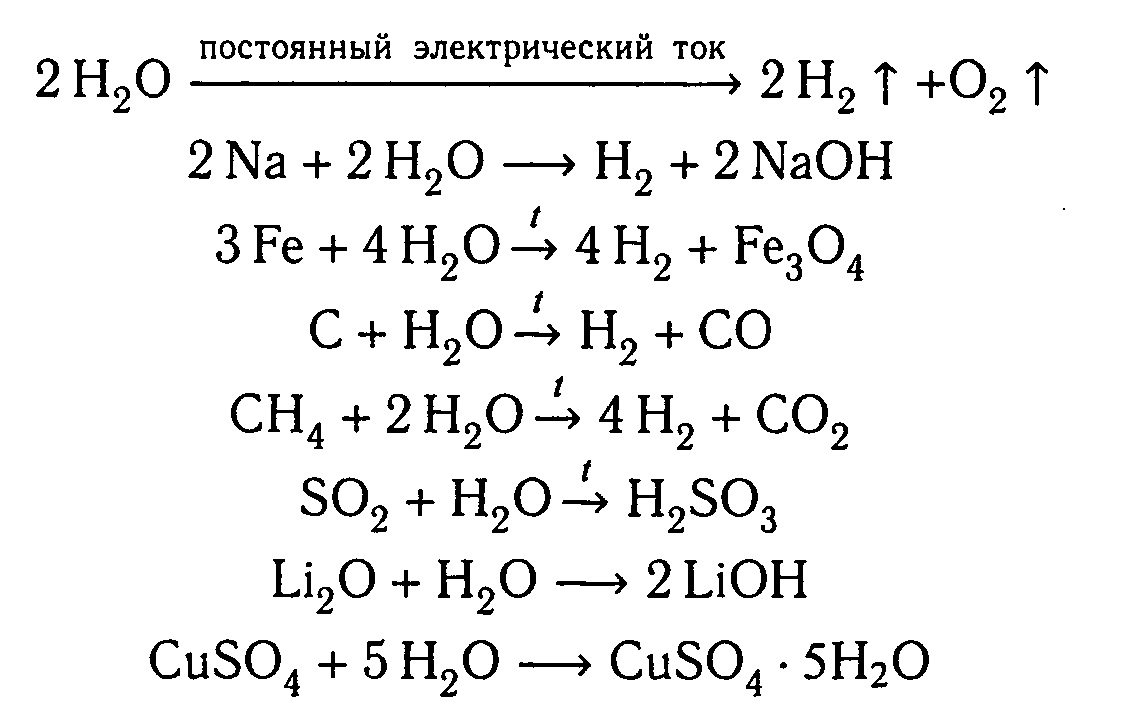
Физические свойства. Газ без цвета, без запаха, без вкуса.. Малорастворим в воде.

Тяжелее воздуха. Молекула: О 2. Валентность II. Химические свойства:. Самый распространенный элемент на Земле.
Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами. Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света. Оксиды — это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Газ без цвета, без запаха, без вкуса.
Самый легкий, собирать его нужно, держа пробирку вверх дном. Имеет высокую теплопроводность. В 14,5 раз легче воздуха. Молекула: Н 2. Валентность I. Один из наиболее распространенных элементов на Земле.
Входит в состав нефти, древесины, угля, природного газа, находится в органических соединениях, содержится в вулканических газах.
В одородные соединения элементов. Гидриды Летучие водородные соединения. Агрегатное состояние кристаллическое, жидкое, газообразное. Без цвета, вкуса и запаха. С — удельная теплоемкость. Химические свойства. ЭО кислотный оксид кислота Н R.
Ряд активности металлов. SO 2 химичес-кие заводы, топливо. Изогнутые стрелки характеризуют происхождение и значение каждого компонента. Горение веществ в воздухе. Схема составления уравнений реакций горения сложных веществ. Записывают формулы исходных и образующихся веществ:. Уравнивают число атомов элементов, входящих в состав сгоревшего вещества:. Если в правой части уравнения получается нечетное число атомов кислорода, то все коэффициенты удваиваются, кроме коэффициента перед О:.
В заключение подсчитывают число атомов кислорода в правой части уравнения и ставят коэффициент перед формулой О:. Этим приемом расстановки коэффициентов пользуются в тех случаях, если в реакции участвуют газы, молекулы которых состоят из двух атомов, например O 2 , Cl 2 , H 2. Тепловой эффект химических реакций.
Реакции, протекающие с выделением теплоты, называют экзотермическими. Реакции, протекающие с поглощением энергии, называют эндотермическими.
Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции. Химические уравнения, в которых указывается тепловой эффект, называют термохимическими.

Химические элементы. Хими - чес-кий. Растворимость кислот, оснований и солей в воде. SO 4 SO 3 PO 4 CH 3 COO -. CO 3 SiO 3 Реакция раствора:. Растворами называют однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
При смешивании некоторых веществ глины, керосина с водой образуются не растворы, а мутные смеси, которые называют взвесями. Взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды, называют суспензиями глина с водой. Взвеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами другой жидкости, называют эмульсиями.
Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным, а раствор, в котором вещество еще может растворяться, - ненасыщенным. Растворимость коэффициент растворимости — максимально возможное число граммов вещества, которое может раствориться в г растворителя при данной температуре. Способы выражения количественного состава раствора. Обозначение молярности. Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород.
Оксиды, которым соответствуют основания, называют основными. Оксиды, которым соответствуют кислоты, называют кислотными. Оксиды, которым соответствуют и основания, и кислоты, называют амфотерными оксидами. Оксиды амфотерных элементов называют амфотерными. Правила составления названия оксида. Физические свойства оксидов. Оксиды бывают твердые, жидкие и газообразные, различного цвета. Получение и химические свойства оксидов. МеО неМеО или. Основания — это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп.
Растворимые щелочи Нерастворимые. Кислоты — сложные химические вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка. Кислоты H x R. Минеральные Органические. Кислородсодержащие Безкислородные уксусная, лимонная,.
При нагревании некоторые кислоты разлагаются на оксид и воду. Изменение цвета индикаторов при действии растворов кислот и щелочей. Цвет индикатора в среде. Метиловый оранжевый. Ряд кислот. HNO 3. Менее летучие кислотные оксиды вытесняют более летучие из их солей. Названия важнейших кислот и солей. Соли — сложные вещества, состоящие из атомов металлов и кислотных остатков. МеR , где R — кислотный остаток. Название кислотного остатка.
Средние соли — это продукты полного замещения атомов водорода в молекуле кислоты на металл. Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл. Введите email и мы отправим вам подборку разработок по теме материала Опорные конспекты по химии 8 класс. Партнерская программа. Версия для слабовидящих Корзина 0 Войти. Войти Забыли пароль? Меню Фильтр Корзина 0 Вход Регистрация. Уважаемые слушатели и пользователи портала УчМет!
Опорные конспекты по химии 8 класс. Курсы переподготовки. Педагогика и методика дошкольного образования ч. Педагогическое образование: учитель общеобразовательной организации предмет ч.
Менеджмент организации ч. Педагогическое образование: специализация ч. Курсы повышения квалификации. Оказание первой помощи пострадавшим 32 ч. Профессиональная компетентность педагога ДО в условиях внедрения новой Федеральной образовательной программы дошкольного образования 72 ч.
Поиск курсов и вебинаров. Войдите , чтобы оценить книгу и оставить отзыв. Описание книги В издании учебный материал курса химии за 8 класс представлен в виде опорных конспектов, которые включают в себя обобщающие таблицы, схемы, рисунки, образцы решения задач, занимательный материал.
Книга О. Сечко, Н. Манкевич «Химия. Опорные конспекты, схемы и таблицы» — читать онлайн на сайте. Оставляйте комментарии и отзывы, голосуйте за понравившиеся. Возрастное ограничение:. Дата выхода на Литрес:. Последнее обновление:. Общий размер:.

Общее кол-во страниц:. С этой книгой читают. Хит продаж. После бури Фредрик Бакман. Книга 12 Серж Винтеркей. Первая трилогия Фрэнк Герберт.
Дюна Фрэнк Герберт. Тоннель Яна Вагнер. Тайные тропы Андрей Васильев. Форсайт Сергей Лукьяненко.